광유전학 기술로 신경 신호 조절해 항우울 효과 회복 가능성 입증고령 환자에서 항우울제 저항 분자적 원인 규명…새 치료 전략 제시
-
- ▲ ⓒKAIST
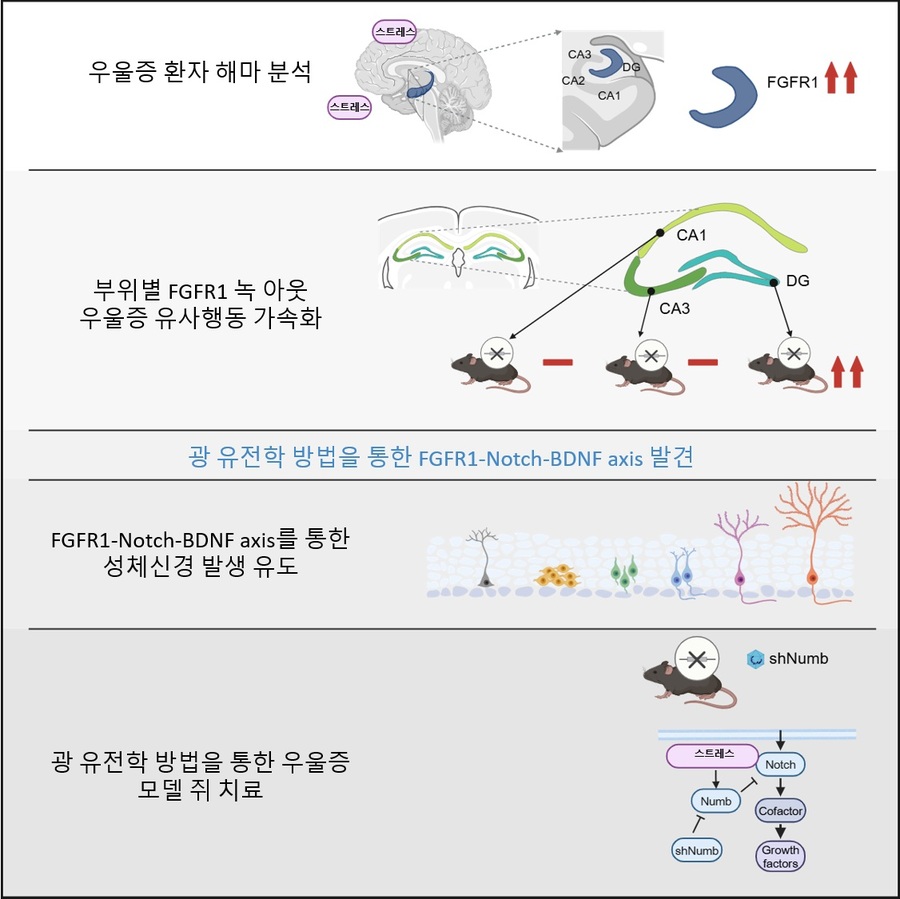
우울증은 전 세계적으로 가장 흔한 정신질환 중 하나지만, 뇌 속 분자·단백질 수준에서의 발병 원인은 아직 명확히 규명되지 않았다. 국내 연구진이 우울증이 단순한 신경세포 손상이 아닌 특정 신경 신호 경로의 교란으로도 발생할 수 있음을 밝혀냈으며, 특히 고령 환자에서 기존 항우울제가 듣지 않는 이유를 분자적으로 규명했다.KAIST(총장 이광형) 생명과학과 허원도 석좌교수 연구팀은 국립과학수사연구원 이민주 법의관, 아주대학교의료원 병리과 김석휘 교수 연구팀과 협력해 극단 선택 환자의 뇌 조직 분석과 면역조직화학 연구를 수행했다. 연구진은 해마 치아이랑(dentate gyrus)에서 스트레스에 따른 신경 신호 경로 변화를 규명하고, 광유전학(optogenetics) 기술을 통해 항우울 효과 회복 가능성을 동물모델에서 실험적으로 입증했다고 19일 밝혔다.연구팀은 우울증 마우스 모델을 활용해 스트레스 상황에서 성장인자(FGF) 수용체인 FGFR1 발현이 크게 증가한다는 사실을 확인했다. 이어 FGFR1 유전자가 제거된 조건부 녹아웃 마우스가 스트레스에 더 취약하다는 점을 규명해 FGFR1의 핵심 역할을 입증했다. 또한 빛으로 FGFR1 신호를 활성화하는 ‘optoFGFR1 시스템’을 개발, 항우울 효과 회복을 실험적으로 확인했다.그러나 노화된 우울증 마우스 모델에서는 FGFR1 신호 활성화에도 항우울 효과가 나타나지 않았다. 연구진은 그 원인이 ‘Numb’ 단백질의 과도한 발현 때문임을 밝혀냈다. 실제 사후 인간 뇌 조직 분석에서도 고령 우울증 환자에게만 Numb 단백질 과발현이 관찰됐으며, 이를 억제하자 다시 항우울 효과가 회복되는 현상이 입증됐다.허원도 석좌교수는 “이번 연구는 우울증의 새로운 발병 기전을 밝혀냈을 뿐 아니라, 고령 환자에서 항우울제가 듣지 않는 원인을 규명한 것에 큰 의미가 있다”며 “Numb 단백질을 표적으로 하는 새로운 치료 전략 개발로 이어질 것”이라고 말했다.이번 연구는 KAIST 박사과정 신종필 연구원이 제1 저자로 참여했으며, 국제 학술지 ‘Experimental & Molecular Medicine’ 8월 15일 자에 게재됐다.







![[단독] 증평 ‘영뜰회’ 지방선거판 '뇌관'으로 부각](https://image.newdaily.co.kr/site/data/thumb/2026/01/26/2026012600356_0_thumb.jpg)