KAIST 이지민 교수 연구팀, ENBL 미하일 사비시키 교수·서울대 백성희 교수 공동 연구
-

- ▲ 이지민 KAIST 의과학대학원 교수.ⓒKAIST
KAIST 의과학대학원 이지민 교수 연구팀이 질환의 억제와 촉진의 실마리가 되는 단백질 수명을 결정하는 단백질 번역 후 조절(post-translational modification) 코드를 규명했다.이 교수는 유럽분자생물학연구소(EMBL) 미하일 사비스키(Mikhail Savitski) 교수, 서울대학교 백성희 교수와 공동 연구를 통해 이같이 성과를 거뒀다.1일 KAIST에 따르면 연구팀은 기존에 단백질의 운명 조절과 연관이 없을 것으로 생각됐던 PTM 신호를 `PTM-활성화(PTM-activated) 데그론'과 `PTM-불활성화(PTM-inactivated) 데그론'으로 구분해 단백질 수명 조절과의 관련성을 규명했다.여기서 데그론 코드란 단백질 수준을 조절 가능한 아미노산 서열의 조합 개념으로 질병의 진행이나 억제의 스위치 역할을 하는 단백질의 수명 조절 코드를 말한다.연구팀은 이를 규명한 결과 기존 치료제가 접근할 수 없는 `기존에 약으로 만들지 못했던(Undruggable)' 신규 타깃의 정확도 높은 치료법 개발의 가능성을 열었다. -
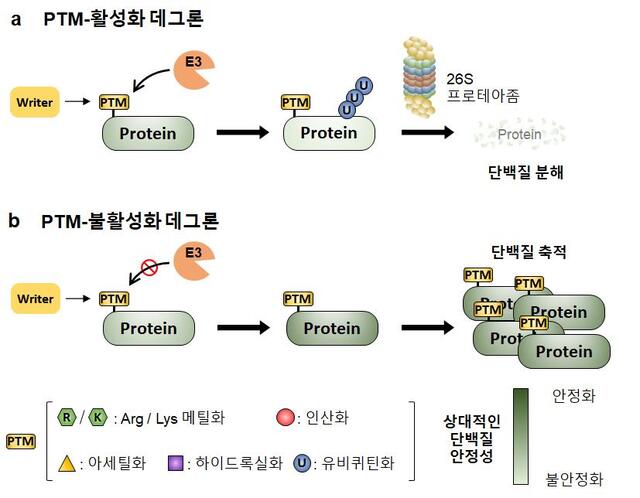
- ▲ ⓒKAIST
연구팀은 신규 PTM 관련 코드를 다각화함으로 인해 단백질 분해 및 생성의 근본 원인을 알 수 없었던 기존의 신호 전달 체계에 PTM을 유도하거나 제거하는 효소의 역할을 재조명했다.이번 연구를 통해 질병 관련 단백질 수명 변화 기원을 PTM 코드로 디지털화해서 미리 규명을 함으로써 그동안 단백질 수준을 마지막 단계에서 조절하는 유비퀴틴 신호에만 집중했던 부분을 변경하도록 제안했다.KAIST 의과학대학원 이지민 교수가 제1 저자로 초청돼 기고한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications, IF 17.69)' 에 지난 13일 자 출판됐다.이 교수는 “새롭게 제시한 PTM-활성화 또는 PTM-불활성화 데그론 코드의 규격화는 기존 약에 반응하지 않거나 저항성이 생기는 단백질 수준을 조절 가능한 다양한 질병 (암·퇴행성 뇌질환)의 진단 및 의약품 개발로 발전시킬 수 있을 것으로 기대된다ˮ 고 밝혔다.한편 번역 후 조절(PTM)은 DNA가 mRNA가는 전사 과정을 거쳐 최종 단백질로 번역까지 일어난 이후에 추가적으로 생기는 현상으로, 단백질의 구조나 효능에 영향을 미치는 것으로 알려져 있다.







